肺癌驱动基因-MET
MET是一种肝细胞生长因子(HGF)酪氨酸激酶受体,是一种由 c-met原癌基因编码的蛋白产物,作为多类肿瘤潜在的治疗靶点被医学研究人员所关注。 在非小细胞肺癌(NSCLC)中,MET 激活途径多样,并通过多种机制影响肺癌细胞的生存、生长和侵袭。大量研究显示,MET 即可以作为 NSCLC 的原发驱动基因,也可作为继发耐药的旁路基因或旁路分子。
MET 通路和靶向治疗 MET 为酪氨酸跨膜受体,NSCLC 中 MET 通路失调机制多样,包括基因突变、扩增、重排和蛋白过表达。目前,针对 MET 或 HGF 靶向治疗的药物主要分为两大类:小分子 TKI 和单克隆抗体。 小分子 TKIs 可进一步分为多重激酶抑制剂(crizotinib, cabozantinib, MGCD265, AMG208, altiratinib, golvatinib)和选择性 MET 抑制剂(竞争性三磷酸腺苷制剂 capmatinib , tepotinib (MSC2156119J) ;非竞争性三磷酸腺苷制剂 tivantinib)。 单克隆抗体可进一步分为抗 MET 抗体(onartuzumab, emibetuzumab [LY2875358])和抗 HGF 抗体(ficlatuzumab [AV-299] , rilotumumab [AMG 102])。 识别出导致 NSCLC 中 MET 通路激活假定改变的多样性,关键是确定区分真正的敏化 MET 信号的佳途径,要么是原发驱动基因,要么是经一系列 EGFR 定向靶向治疗后形成获得性耐药的共同致癌驱动状态。 MET 作为 NSCLC 的原发驱动基因 ALK 重排、EGFR 突变,以此类推,MET 通路可能单独作为 NSCLCs 的初始驱动也是可信的。数据显示,两大 MET 相关状态重叠在 NSCLC 中显示了前途:MET exon 14 (METex14) 改变和 MET 基因扩增。 肺癌伴 METex14 改变
肺癌经常隐藏一些细胞外/近膜结构域的突变,受体激活和二聚化都需要细胞素域的参与,但该结构域与突变的相关性仍不清楚。相反,细胞近膜结构域的突变往往会导致 METex14 改变。METex14改变形式极其多样,为常见的是MET exon 14 剪接突变,其多样性给诊断实验带来了挑战。METex14 改变的检测率除了受检测手段的影响,还会随组织学类型、TNM 分期等发生变化。
表 1. 普遍采用的检测 NSCLC 中 MET ex14 改变和 MET 扩增的实验方法
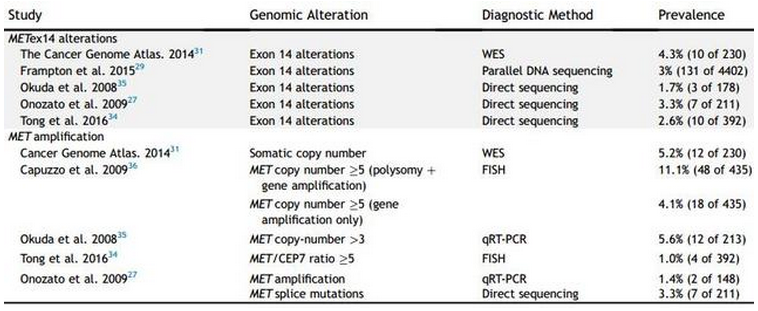
METex14 改变与其他肺癌驱动基因具有相互排外性,这也意味着它是个真正的致癌驱动状态。一项含 933 例非鳞癌 NSCLC 研究显示:伴 METex14 改变的患者将不会有 KRAS、EGFR、ERBB2 基因突变或 ALK、ROS1、RET 重排。相反,METex14 改变可与 MET、MDM2 扩增相重叠。 METex14 改变可能对 MET 抑制剂疗效具有很高的预测性,MET 抑制剂疗效的报道也进一步促进了聚焦于 METex14 改变这一分子药物的研发。目前对 MET TKIs 获得性耐药机制的研究已展开,包括新报道的 MET D1228N 假定机制。
MET 扩增是 MET 信号通路异常从而使酪氨酸蛋白过表达并持续激活,在接受一系列EGFR TKI治疗后形成获得性耐药的肺癌细胞中可发现 MET 拷贝数增加,该变化主要源于两大过程:多染色体和扩增。可利用荧光原位杂交(FISH)对 MET 与7号染色体(CEP7)在着丝粒部分的比例来区分多染色体和真正的扩增。另外,杂交捕获 NGS 也能检测扩增事件。但目前,还没达到根据基因拷贝数量来鉴别 MET 阳性的共识。据报道,取决于预选的水平、检测手段及所采用的阳性截点,普遍接受的 NSCLC 中新的 MET/CEP7 的范围为 1%-5%。
表 2. MET/CEP7 比值和 MET 扩增等级
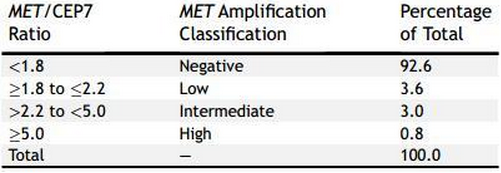
目前,有两个重要的问题与探索 MET 扩增作为 MET 抑制治疗是否获益的预测性生物标志物相关。第一,在一大群肺腺癌患者中 MET/CEP7 比值为 5及以上的仅有0.34%,而在同一人群中,METex14 改变的有近 10%;第二,该人群的临床获益程度并不取决于 METex14 突变仍需调研。 此文已将 METex14 改变作为 MET 抑制治疗是否获益的预测性生物标志物。但是,MET 扩增是否只是一些 METex14 案例的代替,亦或是在没有 METex14 改变的情况下 MET 扩增能够真的独立的反应 MET 抑制的临床反应,然而目前仍不明确。 MET 作为 NSCLC的共同驱动基因 MET 信号通路与其他信号通路间存在交互作用,纵观 NSCLCs 靶向治疗历史,很多研究人员在 NSCLCs 患者临床试验中选择联合使用 MET 抑制剂和 EGFR 抑制剂,部分原因是 MET 和 EGFR 在驱动原癌基因中具有协同作用,如 EGFR 野生型肺癌和 EGFR TKIs 治疗后获得性耐药的突变肺癌模型中均显示了疗效。 EGFR 突变肺癌中 MET 抑制剂 据报道,EGFR TKI 治疗形成获得性耐药 EGFR 突变肺癌中 MET 扩增发生率达15%-20%,而后续一系列研究提出的 MET 扩增率较低(约5%),并与其他获得性耐药机制相重叠,如获得性 EGFR T790M 或小细胞转化。不出所料,获得性 MET 扩增可作为抗第三代 EGFR TKI 治疗耐药,EGFR T790M阳性肺癌的治疗。
